Creado por: Martínez Vásquez Bryan Andrés
Grado: 11-3T
Aldehídos
Propiedades generales o físicas:
La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomérica.
Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio, la reacción tiene que ser débil , las cetonas también se obtienen de la deshidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados con permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
El grupo carbonilo de los aldehídos en fuertemente reactivo y participa en una amplia variedad de importantes transformaciones, que hacen de la química de los aldehídos un tema extenso y complejo.
Se comportan como reductor, por oxidación el aldehído de ácidos con igual número de átomos de carbono.
La reacción típica de los aldehídos y las cetonas es la adición nucleofílica.
Gráficas alusivas a los aldehídos:
.jpg)

Usos de los aldehídos en la industria:
El metanal o aldehído fórmico es el aldehído con mayor uso en la industria, se utiliza fundamentalmente para la obtención de resinas fenólicas y en la elaboración de explosivos (pentaeritrol y el tetranitrato de pentaeritrol, TNPE) así como en la elaboración de resinas alquídicas y poliuretano expandido.
También se utiliza en la elaboración de uno de los llamados plásticos técnicos que se utilizan fundamentalmente en la sustitución de piezas metálicas en automóviles y maquinaria, así como para cubiertas resistentes a los choques en la manufactura de aparatos eléctricos. Estos plásticos reciben el nombre de POM (polioximetileno)
Muchos aldehídos y cetonas forman parte de los aromas naturales de flores y frutas, por lo cual se emplean en la perfumería para la elaboración de aromas como es el caso del benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela). De origen animal existe la muscona y la civetona que son utilizados como fijadores porque evitan la evaporación de los aromas además de potenciarlos por lo cual se utilizan en la industria de la perfumería.
Beneficios y riesgos para la salud:
Riesgos:
Los dos efectos más importantes de los aldehidos son: narcotizantes e irritantes
Los principales efectos del formaldehido son: irritación de las vías respiratorias y ojos y dermatitis (las resinas). El NIOSH lo ha propuesto como potencialmente cancerígeno.
Los efectos nocivos del furfural son, fundamentalmente: irritativos respiratorios, dérmicos y oculares (a temperatura ambiente, presenta un riesgo limitado de toxicidad).
Beneficios:
No se conocen beneficios de los aldehídos para la salud.
Nombre y estructura química de los aldehídos:
Nombre y estructura química de los aldehídos:
Bibliografia:
https://www.google.com.co/search?q=aldehidos&tbm=isch&tbo=u&source=univ&sa=X&ei=9PgHUqSJBZLy8ASau4Ao&sqi=2&ved=0CDkQsAQ&biw=1366&bih=667#facrc=_&imgdii=_&imgrc=OsT6pbjmvrXHMM%3A%3BqHMljp93HeMOaM%3Bhttp%253A%252F%252Fhtml.rincondelvago.com%252F0000383817.png%3Bhttp%253A%252F%252Fhtml.rincondelvago.com%252Fformulacion-y-nomenclatura-organica.html%3B1392%3B591
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fatilia-funcionesquimicasorganicas.blogspot.com%2F2009%2F11%2F2.html&h=0&w=0&sz=1&tbnid=0QnGEjt3K4YG6M&tbnh=225&tbnw=225&zoom=1&docid=auaMDgldR6-pGM&ei=BP0HUpvNJoiQ9gT31YCAAQ&ved=0CAEQsCU
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fatilia-funcionesquimicasorganicas.blogspot.com%2F2009%2F11%2F2.html&h=0&w=0&sz=1&tbnid=0QnGEjt3K4YG6M&tbnh=225&tbnw=225&zoom=1&docid=auaMDgldR6-pGM&ei=BP0HUpvNJoiQ9gT31YCAAQ&ved=0CAEQsCU#imgdii=0QnGEjt3K4YG6M%3A%3BaE8xr7QMvW5RgM%3B0QnGEjt3K4YG6M%3A
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fhtml.rincondelvago.com%2Fcompuestos-organicos.html&h=0&w=0&sz=1&tbnid=sOrCxznjrAHmzM&tbnh=152&tbnw=332&zoom=1&docid=YKhmOSpIGFM1iM&ei=cP0HUsz7DZTi8gSr3IGABA&ved=0CAYQsCU
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fosvaldo-diaz.blogspot.com%2F2012%2F03%2Falcoholes-aldehidos-cetonas-acido.html&h=0&w=0&sz=1&tbnid=3kOaGSf5vdffdM&tbnh=168&tbnw=219&zoom=1&docid=MRlZWluPeb1LcM&ei=lP0HUuDZK5Tg8ASmpICQCQ&ved=0CAQQsCU
Información sobre el trabajo:
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_aldehidos_cetonas.htm
http://www.elergonomista.com/aldehidos.htm
Cetonas:
Propiedades generales o físicas:
Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.
Las cetonas hasta un tamaño de 10 carbonos son líquidas. Por encima de 10 carbonos son sólidos.
Las primeras tienen un olor particular agradable, las siguientes son de olor fuerte desagradable y las superiores son inodoras.
Las alifáticas son todas menos densas que el agua. La propanona presenta solubilidad en agua, las otras son poco solubles. Si son solubles en éter, cloroformo, etc…
Propiedades químicas:
Adición de Hidrógeno:
Al igual que los aldehídos, las cetonas pueden adicionar átomos de hidrógeno en presencia de catalizadores.
Oxidación:
Los aldehídos se oxidan con facilidad. En presencia de un oxidante fuerte y calor, se rompe la cadena a la altura del grupo funcional y se forman dos moléculas de ácido.
Reacciones de sustitución:
Con halógenos dan reacciones de sustitución:
Al igual que los aldehídos, las cetonas experimentan un proceso de condensación entre sus moléculas.
Gráficas alusivas a los aldehídos:
Utilidades de las cetonas en la industria:
Son utilizadas como disolventes orgánicos, removedor de barniz de uñas (acetona). Otras aplicaciones a mencionar son las siguientes; Obtención de resinas sintéticas, antiséptico, embalsamamiento, desodorante, fungicidas, obtención de Exógeno o Ciclonita (explosivos), preparación de pólvoras sin humo; además que son aprovechados para la obtención de Cloroformo y Yodoformo.
Beneficios y riesgos para la salud:
Riesgos:
Los riesgos de las cetonas son muy parecidos por no decir los mismos de los aldehídos.
Estos son sequedad en la piel ardor, sarpullido o sensación de ardor y agrietamiento en la piel.
En los ojos los puede irritar o quemar gravemente y llevar a daño permanente en la vista.
Respirar metil etil cetona puede irritar la nariz y la garganta y causar tos con respiración con mucosa.
La exposicion puede generar mareos, sensación de desmayo, dolor de cabeza visión borrosa y desmayo.
Beneficios:
No se conocen beneficios de las cetonas para la salud.
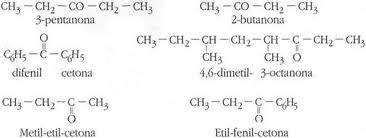
Nombre y estructura química de las cetonas:
Bibliográfia:
Información sobre el trabajo:
http://nj.gov/health/eoh/rtkweb/documents/fs/1258sp.pdf
http://aldehidosycetona.blogspot.com/2010/08/usos-aldehidos-y-cetonas.html
http://www.quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/cetonas
Imágenes:
http://www.quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/cetonas
https://www.google.com.co/search?hl=es&site=imghp&tbm=isch&source=hp&biw=1366&bih=667&q=cetonas&oq=cetonas&gs_l=img.3..0l10.57751.58716.0.58816.7.7.0.0.0.0.144.597.2j4.6.0....0...1ac.1.24.img..3.4.322.Lrot3Cv___4#facrc=_&imgdii=_&imgrc=ReJQZ_yC7qoGrM%3A%3BS2kRzBYrYhEvnM%3Bhttp%253A%252F%252Fupload.wikimedia.org%252Fwikipedia%252Fcommons%252Fthumb%252Fb%252Fb5%252FAcetone-displayed.png%252F220px-Acetone-displayed.png%3Bhttp%253A%252F%252Fes.wikipedia.org%252Fwiki%252FCetona_(qu%2525C3%2525ADmica)%3B220%3B168
https://www.google.com.co/search?hl=es&site=imghp&tbm=isch&source=hp&biw=1366&bih=667&q=cetonas&oq=cetonas&gs_l=img.3..0l10.57751.58716.0.58816.7.7.0.0.0.0.144.597.2j4.6.0....0...1ac.1.24.img..3.4.322.Lrot3Cv___4#facrc=_&imgdii=_&imgrc=TCgc0NcnkEkWlM%3A%3B4ZcOgMTYhzit9M%3Bhttp%253A%252F%252Fwww.sabelotodo.org%252Fquimica%252Fimagenes%252Fcetonas.png%3Bhttp%253A%252F%252Fwww.sabelotodo.org%252Fquimica%252Fcetonas.html%3B379%3B219
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fherbolarioplus.es%2FPack-Cetonas-de-Frambuesa-Drena-Xtrem&h=0&w=0&sz=1&tbnid=gaV9W3Loxo5JmM&tbnh=225&tbnw=225&zoom=1&docid=mcP_eeIMDq-LGM&hl=es&ei=HAAJUvTTEoia9gTt2YHIBQ&ved=0CAQQsCU
https://www.google.com.co/search?q=ciclo+cetona&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=go8JUs2wAYX29gSs3oGQCQ&biw=1366&bih=667&sei=j48JUpj-E5Sc9QSGpICwAQ#facrc=_&imgdii=dRg_JaSc7lgB-M%3A%3BU7_MtYkNOJcvkM%3BdRg_JaSc7lgB-M%3A&imgrc=dRg_JaSc7lgB-M%3A%3BWbnCRry9Le8LrM%3Bhttp%253A%252F%252Fupload.wikimedia.org%252Fwikipedia%252Fcommons%252Fc%252Fc8%252FCyclopentanone.png%3Bhttp%253A%252F%252Fes.wikipedia.org%252Fwiki%252FCiclopentanona%3B817%3B1363
http://www.quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/cetonas
https://www.google.com.co/search?hl=es&site=imghp&tbm=isch&source=hp&biw=1366&bih=667&q=cetonas&oq=cetonas&gs_l=img.3..0l10.57751.58716.0.58816.7.7.0.0.0.0.144.597.2j4.6.0....0...1ac.1.24.img..3.4.322.Lrot3Cv___4#facrc=_&imgdii=_&imgrc=ReJQZ_yC7qoGrM%3A%3BS2kRzBYrYhEvnM%3Bhttp%253A%252F%252Fupload.wikimedia.org%252Fwikipedia%252Fcommons%252Fthumb%252Fb%252Fb5%252FAcetone-displayed.png%252F220px-Acetone-displayed.png%3Bhttp%253A%252F%252Fes.wikipedia.org%252Fwiki%252FCetona_(qu%2525C3%2525ADmica)%3B220%3B168
https://www.google.com.co/search?hl=es&site=imghp&tbm=isch&source=hp&biw=1366&bih=667&q=cetonas&oq=cetonas&gs_l=img.3..0l10.57751.58716.0.58816.7.7.0.0.0.0.144.597.2j4.6.0....0...1ac.1.24.img..3.4.322.Lrot3Cv___4#facrc=_&imgdii=_&imgrc=TCgc0NcnkEkWlM%3A%3B4ZcOgMTYhzit9M%3Bhttp%253A%252F%252Fwww.sabelotodo.org%252Fquimica%252Fimagenes%252Fcetonas.png%3Bhttp%253A%252F%252Fwww.sabelotodo.org%252Fquimica%252Fcetonas.html%3B379%3B219
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fherbolarioplus.es%2FPack-Cetonas-de-Frambuesa-Drena-Xtrem&h=0&w=0&sz=1&tbnid=gaV9W3Loxo5JmM&tbnh=225&tbnw=225&zoom=1&docid=mcP_eeIMDq-LGM&hl=es&ei=HAAJUvTTEoia9gTt2YHIBQ&ved=0CAQQsCU
https://www.google.com.co/search?q=ciclo+cetona&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=go8JUs2wAYX29gSs3oGQCQ&biw=1366&bih=667&sei=j48JUpj-E5Sc9QSGpICwAQ#facrc=_&imgdii=dRg_JaSc7lgB-M%3A%3BU7_MtYkNOJcvkM%3BdRg_JaSc7lgB-M%3A&imgrc=dRg_JaSc7lgB-M%3A%3BWbnCRry9Le8LrM%3Bhttp%253A%252F%252Fupload.wikimedia.org%252Fwikipedia%252Fcommons%252Fc%252Fc8%252FCyclopentanone.png%3Bhttp%253A%252F%252Fes.wikipedia.org%252Fwiki%252FCiclopentanona%3B817%3B1363



.jpg)





.png)
.png)
.png)





.jpg)


Gracias!
ResponderEliminarGracias!
ResponderEliminar
ResponderEliminarmuy buena información
ResponderEliminarMuchas gracias por la informacion
ResponderEliminar